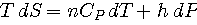thermodinamique 2
d- transformations adiabatiques: Rappelons que nous sommes dans le cas des transformations:
- de gaz parfaits,
- quasi-statiques,
- sans échange de matière,
- sans échange de chaleur.

en remplaçant P par

on obtient:



|
|
Homogène à PV.
On peut ensuite remplacer le rapport des volumes par celui des pressions ou par celui des températures.
F - DETENTES DE FLUIDES
|
Détente de Joule/Gay-Lussac |
Détente de Joule/Thompson |
|
|
|
|
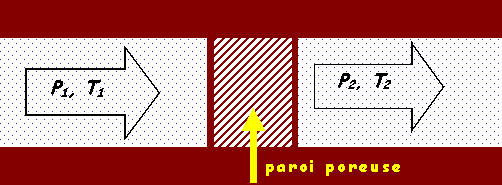
Lorsqu’on supprime la paroi, le gaz subit une détente telle que Uf = Ui ou encore |
Ecoulement d’un fluide à travers une paroi poreuse. Si l’écoulement est lent, adiabatique, sans échange de travail, alors H1 = H2 ou encore |
G - DEUXIEME PRINCIPE
- Enoncé: il existe une fonction d’état S, appelée entropie, fonction extensive des paramètres d’état extensifs, et qui peut varier par échange de chaleur ou de matière avec l’extérieur par création à la suite de phénomènes irréversibles.
|
|
- système isolé:

l'entropie ne peut qu'augmenter.
- transformation. adiabatique réversible d’un système fermé

- transformation.cyclique quelconque:  car Sest une fonction d’état .
car Sest une fonction d’état .
- transformation.réversible d’un système fermé:

- transformation. infinitésimale, réversible ou non:
|
H - MACHINES THERMIQUES
|
|
Les valeurs algébriques W, Q1 et Q2 sont relatives à la machine thermique.
On suppose que le système mécanique n'échange que du travail et que l'évolution au contact des sources de chaleur est réversible.
- au cours d'u n nombre n entier de cycles:
|
premier principe appliqué à la machine thermique |
|
|
second principe appliqué à l'ensemble |
|
rendement et efficacité
|
Moteur thermique |
|
|
|
Frigidaire |
|
|
|
Pompe à chaleur |
|
|
Remarquons que pour les 2 derniers cas (congélateur et pompe à chaleur), tous les signes sont identiques. Dans la pompe à chaleur, c'est la source chaude (eau des canalisations) qui est le centre d'intérêt alors que pour le frigidaire, c'est la source froide (compartiment du frigo).
I - COEFFICIENTS CALORIMETRIQUES
(exemples pour un fluide homogène)
- définitions:
|
|
- U fonction d'état:

|
|
- S fonction d'état:

|
|
Des 2 dernières relations, on exprime:
|
|
relation de Clapeyron.
- H et S fonction d'état:
|
|
relation de Clapeyron.
- Expressions TdS:
de
|
|
et de
|
|
on tire:
|
|
|
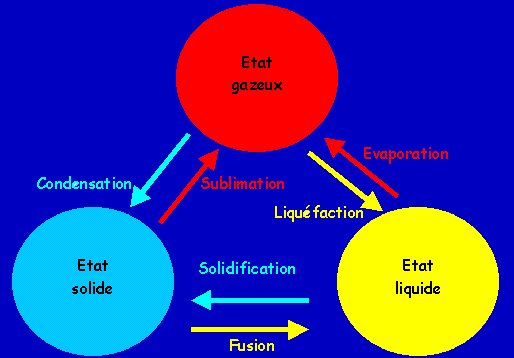
J - CHANGEMENTS D'ETAT
|
|
- définitions:
|
|
- équilibre entre 2 phases alors une seule variable indépendante.Si on fixe V, alors P. = f ( T ) dont le graphe constitue la courbe de fusion, de sublimation... le long de ces courbes,il y a équilibre entre 2 phases.
- diagramme P - T d’un corps pur:
|
|
Tr est le point triple. C est le point critique.
- S, L, G sont les domaines de stabilité du solide, du liquide et du gaz.
- Sur les courbes vertes, il y a équilibre entre 2 phases.
- Au point triple, il y a coexistence des 3 phases en équilibre. Ce point est unique pour un corps pur donné. Pour l'eau, ses coordonnées sont:
|
P = 610 Pa |
T = 0,01 °C = 273,16 K |
|
|
( point fixe de l'échelle Thermodynamique ) |
- la courbe de fusion-solidification est pratiquement rectiligne, de pente (dP/dT)V très grande et positive (pour la majorité des corps). Pour l'eau, cette pente est négative.
- la courbe de vaporisation est limitée par le point critique C: pour liquéfier un gaz par détente, par exemple, il faut abaisser sa température au-dessous de sa température critique.
- différents cas:
|
|
• transformation ( 1 ): on opère sous une pression inférieure à celle du point triple. Le corps s'échauffe puis se sublime lorsque le point figuratif traverse la courbe de sublimation-condensation. La température présente alors un palier. Il est ensuite entièrement à l'état gazeux.
• transformation ( 2 ): P > PTr le corps fond puis bout ( 2 paliers de température ).
• transformation ( 3 ): on passe graduellement du gaz au liquide sans transition nette. Au début, le corps est entièrement gazeux; à la fin il est entièrement liquide et dans les 2 états extêmes, il occupe entièrement le récipient de volume constant. A aucun moment on n'a aperçu un ménisque de séparation gaz-liquide et on ne voit même pas que l'on a obtenu un liquide. Pour s'en rendre compte, il suffit de procéder à une détente: le point figuratif de l'état du corps traverse la courbe de vaporisation-liquéfaction et l'on observe des bulles de gaz, preuve qu'on avait bien un liquide. Il n'y a pas de discontinuité entre l'état liquide et l'état gazeux.
- chaleur latente massique de changement d'état: c'est la chaleur que l'unité de masse du corps doit échanger pour subir le changement d'état à pression et température constantes. Pour les 3 états physiques, il y a 6 chaleurs latentes massiques, deux à deux opposées.
|
|
|
|
|
|
|
|
Au point triple,

- chaleur latente molaire de changement d'état: relative à une quantité de matière de une mole. Il y a aussi 6 chaleurs latentes molaires 2 à 2 opposées.

- entropie de changement d'état:
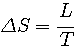
- relation de Clapeyron: elle relie la chaleur latente massique (ou molaire) à la pente de la courbe de changement d'état dans un diagramme P-T et aux volumes massiques (ou molaires) du corps dans les 2 phases concernées:
|
|
P V est en joules, P v est en J.kg-1 ou en J.mol-1. Ainsi, L est en J.kg-1 ou en J.mol-1.
T est la température au palier de changement d'état.
Pour l'eau,

pente négative.


 .
.