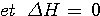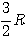THERMODYNAMIQUE 1
|
THERMODYNAMIQUE |
A - LES SYSTEMES
- Système: corps ou ensemble de corps à l'étude.
- Milieu extérieur ou milieu 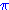 : tout le reste de l'Univers.
: tout le reste de l'Univers.
- Système isolé: n’échange ni énergie, ni matière avec le milieu extérieur.
- Système fermé: peut échanger de l’énergie mais pas de matière avec l’extérieur.
- Système ouvert: peut échanger matière et énergie avec l’extérieur.
B - VARIABLES THERMODYNAMIQUES
On ne peut parler de l'état d'un système que si les grandeurs physiques que l'on peut lui attribuer sont les mêmes en chacun de ses points et si ces grandeurs sont constantes dans le temps.
L’état d’un système est décrit par des paramètres ou variables d’état. Pour les fluides ( liquides, gaz ou plasmas ) les variables thermodynamiques les plus utilisées sont la pression P, le volume V et la température T. mais cela pourrait être toute autre grandeur physique. Le choix des variables thermodynamiques est dicté par la commodité, la précision de mesure ou la facilité de représentation. La relation entre P,V et T est l’équation d’état du fluide. Cette équation est déterminée par la mesure expérimentale des coefficients thermoélastiques: (voir les lettres grecques)
|
|
en K-1
|
|
en K-1
|
|
en Pa-1
Ce sont des grandeurs intensives.
On rappelle que
|
|
il s'ensuit:
|
|
- Gaz parfait: son équation d’état est:
|
|
où R, constante des gaz parfaits, vaut 8,314 J.K-1.mol-1
P en pascals ( Pa ), V en m3, n en moles ( mol ) et T en kelvins (( K ) on ne précise pas degré kelvin).
Le produit PV est en joules, comme un travail ou une énergie.
- Si les 4 variables thermodynamiques varient, seule la quantité
|
|
est constante.
- Si un gaz parfait n'échange pas de matière, alors n est constante et:
|
|
|
|
 voulant dire "se comporte comme".
voulant dire "se comporte comme".
- Si M (en g.mol-1 dans ce cas ) est la masse molaire d'un gaz parfait, sa densité par rapport à l'air est:
|
|
29 g.mol-1 est la masse molaire de l'air.
Composition approximative de l'air:
|
Nom du gaz |
Formule brute |
Masse molaire ( g.mol-1 ) |
Abondance |
|
Diazote |
N2 |
28 |
78 % |
|
Dioxygène |
O2 |
32 |
21 % |
|
Argon |
Ar |
40 |
1 % |
Voir une classification périodique des éléments
- Pour un gaz parfait qui évolue sans échange de matière, de façon adiabatique et quasi-statique,
|
|
on en déduit:
|
|
|
|
|
ou encore pour les 2 dernières |
|
|
Bien sûr, la constante n'a pas la même valeur dans ces différents cas.
- Gaz réels: si P faible, ils ont un comportement presque parfait. Sinon on peut les décrire par différentes équations d’état dont une des plus importantes est celle de Van der Waals:
|
|
b est le covolume, a/V2 est la pression interne.
- Variables intensives: elles ne dépendent pas de la taille du système et ont même valeur en tout point du système.
Exemple: P et T.
- Variables extensives: dépendent de la taille du système et se rapportent à l’ensemble du système.
Exemple:: n quantité de matière et V.
- Equation d’état d’une barre ou d’un fil soumis à une traction F:
|
|
 est le coefficient de dilatation (voir un tableau)
est le coefficient de dilatation (voir un tableau)
S est la section de la barre . E est le module d'Young. La section intervient pour la traction mais "pas" pour la dilatation. F/(ES) est sans unité.
C- TRANSFORMATIONS D’UN SYSTEME
- Transformations réversibles: succession d’états d’équilibre infiniment voisins, l’équilibre étant réalisé à l’intérieur du système et entre le système et l’extérieur: à chaque instant Psystème est définie et Psystème = Pextérieure
- Transformations quasi-statiques: succession d'états d’équilibre interne du système, une telle transformation est lente vis à vis d’un temps caractéristique du système.
- Remarque: l’équilibre mécanique ( Psystème = Pextérieure ) étant beaucoup plus rapide à obtenir que l’équilibre thermique ( Tsyst = Text ), une transformation peut paraître quasi-statique ou réversible du point de vue mécanique mais irréversible du point de vue thermique.
- Transformation irréversible: non réversible.
- Transformation isobare:le système est soumis à une pression extérieure constante et il ne suffit pas que Pfinale = P initiale.
|
pour un G.P. sans échange de matière |
|
- Transformation monobare: même pression au début et à la fin.
- Transformation. isotherme: la température T du système reste constante donc définie.
|
pour un G.P. sans échange de matière |
|
loi de Mariotte.
- Transformation monotherme: même température au début et à la fin.
- Transformation isochore: le volume V du système reste constant.
|
pour un G.P. sans échange de matière |
|
- Transformation adiabatique: pas d’échange de chaleur Q avec l’extérieur.
- Transformation cyclique: l’état final est identique à l’état initial.
D - PREMIER PRINCIPE
- Enoncé: a) l’énergie interne U est la somme de l’énergie cinétique microscopique ( agitation thermique ) et de l’énergie potentielle d’intéraction entre les différentes parties du système.
b) U est une fonction d’état ( fonction des variables d’état ) et sa variation  U, entre un état initial et un état final, est indépendante du chemin suivi par la transformation.
U, entre un état initial et un état final, est indépendante du chemin suivi par la transformation.  U ne dépend que de ces 2 états extrêmes.
U ne dépend que de ces 2 états extrêmes.
c) U peut varier par échange de travail, de chaleur ou de matière entre le système et l'extérieur
Coefficients de dilatation linéaire
Définition
|
|
en °C-1 ou en K-1
Lyre de dilatation
|
|
Coefficients de dilatation linéaire
|
|
suivante :
- Traduction physique: au cours d’une transformation infinitésimale d’un système fermé dont l'énergie cinétique macroscopique est constante:
|
|
dU est la variation d’énergie interne,  représente l’échange de chaleur et
représente l’échange de chaleur et  l’échange de travail.
l’échange de travail.
|
Pour une transformation finie, |
|
On évitera l'écriture |
W et Q dépendent du chemin suivi par la transformation mais leur somme  n'en dépend pas.
n'en dépend pas.
- Convention de signe: si  > 0, le système reçoit effectivement de la chaleur de l’extérieur. Si Q < 0, le système donne effectivement de la chaleur au milieu extérieur. Même convention de signe pour le travail.
> 0, le système reçoit effectivement de la chaleur de l’extérieur. Si Q < 0, le système donne effectivement de la chaleur au milieu extérieur. Même convention de signe pour le travail.
- Travail des forces de pression:
|
|
Pext 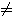 Cte, en général
Cte, en général
Si la transformation est réversible ou même simplement quasi-statique du point de vue mécanique, Pext  Pfluide et l’on peut utiliser l’équation d’état de celui-ci ou toute autre équation vérifiée par le fluide. On aura tout intérêt à trouver une expression P = f (V) pour faciliter l'intégration ultérieure.
Pfluide et l’on peut utiliser l’équation d’état de celui-ci ou toute autre équation vérifiée par le fluide. On aura tout intérêt à trouver une expression P = f (V) pour faciliter l'intégration ultérieure.
- Cas d'une transformation finie:
|
|
- Signification géométrique du travail dans un diagramme (P,V) ou diagramme de Clapeyron:
On ne peut représenter une transformation par une courbe que si chacun des points de celle-ci représente un état bien défini du gaz. La transformation doit être quasi-statique ou réversible pour être représentable par un diagramme.
Soit un gaz qui évolue de façon quasi-statique de A à B.
|
|
Lorsque son volume a varié de dV, variation assez petite pour que la pression soit constante sur ce trajet infinitésimal, le gaz a échangé le travail - PdV, quantité opposée à l'aire hachurée.
Dans un diagramme de Clapeyron, le travail des forces pressantes échangé par un gaz qui évolue de façon quasi-statique est opposé à l'aire "sous" la courbe.
Il est alors aisé de constater que:
- Le travail dépend du chemin suivi:
|
|
Pour aller de A à B, l'aire, et donc le travail, ne sont pas les mêmes suivant que le trajet est direct ou que l'état du gaz passe par I ou par J.
Il s'ensuit que la chaleur QAB dépend aussi du chemin suivi car, U étant une fonction d'état, elle est indépendante du chemin suivie; mais toujours égale à W + Q.
|
|
- Pour un cycle:
|
|
Wcycle = - aire ( sous AIB ) - aire ( sous BJA ) = - Aire du cycle.
Note: dans un diagramme de Clapeyron, les isothermes et les adiabatiques d'un gaz parfait sont toutes les 2 à pente variable mais négative. L'adiabatique est plus pentue que l'isotherme qui passe par le même point.
- Enthalpie H: c’est une fonction d’état, donc sa variation 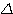 H ne dépend que des états initial et final mais pas du chemin suivi par la transforatation). L'enthalpie H est définie de la façon suivante:
H ne dépend que des états initial et final mais pas du chemin suivi par la transforatation). L'enthalpie H est définie de la façon suivante:
|
|
Comme U et PV, elle s'exprime en joules.
Pour une transformation infinitésimale,
|
|
- Transformation isochore:
|
|
|
|
|
pour un fluide qui évolue à volume constant |
(Q est souvent notée Qv et désignée par chaleur à volume constant. On peut mesurer des chaleurs de réaction à volume constant dans des bombes calorimétriques)
- Transformation entre 2 états tels que P = Pext:
|
|
|
|
|
|
||
(Q est souvent notée QP et désignée par chaleur à pression constante)
En thermochimie, on donne souvent les chaleurs de réaction  à pression constante (pression atmosphérique).
à pression constante (pression atmosphérique).
-Transformation adiabatique:
|
|
- Transformation cyclique:
|
|
|
- Système isolé:
|
|
E - PROPRIETES ENERGETIQUES DES GAZ PARFAIT
- U ne dépend que de T (1ère loi de Joule):
|
|
CV est la capacité calorifique molaire à volume constant.
- Remarque importante:  = 0 pour un gaz parfait qui évolue de façon isotherme ( même température tout au long de la transformation ) ou monotherme ( même température finale et initiale ) et
= 0 pour un gaz parfait qui évolue de façon isotherme ( même température tout au long de la transformation ) ou monotherme ( même température finale et initiale ) et 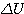 = 0 pour tout cycle d'un système, même si ce n'est pas un gaz et même si la transformation est irréversibe.
= 0 pour tout cycle d'un système, même si ce n'est pas un gaz et même si la transformation est irréversibe.
- H ne dépend que de T:
|
|
CP est la capacité calorifique molaire à pression constante.
- Relation de Robert Mayer:
|
|
Molaires.
- On pose:
|
|
Sans unité, supérieur à 1.
|
Atomicité du gaz parfait |
Exemples |
Cp |
Cv |
|
|
1 |
He, Ne, Ar, Kr... |
|
|
|
|
2 |
H2, N2, O2, air, HCl, Cl2.... |
|
|
|
Molaires,  est intensive.
est intensive.
- On en déduit:
|
|
|
Molaires.
- Travail des forces de pression au cours de transformations irréversibles et sans échange de matière:
Mis à part le cas trivial d'une transformation isochore ( V = Cte, alors W = 0 ), un autre cas simple est celui où la pression extérieure est constante, différente de celle du gaz puisque celle-ci peut ne pas être n'est pas définie ( pas la même pression en tout point, par exemple s'il y a des tourbillons dans le gaz ).
|
|
Homogène et signe correct.
- Travail des forces de pression au cours de transformations quasi-statiques et sans échange de matière:
a) transformations isochores:
|
|
b) transformations isobares:
|
|
PV est en joules.
c) transformations isothermes:


|
|







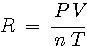




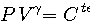












 en °C-1
en °C-1 en °C-1
en °C-1

 ou
ou  ainsi que l'expression "quantité" de chaleur ou de travail.
ainsi que l'expression "quantité" de chaleur ou de travail.