Détermination d'une formu
Détermination d'une formule brute- Recherche d'isomères
1°) Un hydrocarbure CxHy a une atomicité égale à 23 et sa molécule comporte 9 atomes d'hydrogène de plus que d'atomes de carbone.
a) établir un système de deux équations à 2 inconnues (x,y), le résoudre et déterminer la formule brute de cet hydrocarbure.
b) s'agit-il d'un alcane? Pourquoi?
2°) l'octane C8H18 possède plusieurs isomères.
a) écrire la formule semi-développée de 5 de ses isomères.
b) équilibrer l'équation chimique de la combustion de l'octane.
c) on fait brûler une mole de cet alcane. Déterminer la masse des deux réactifs et celle des deux produits de la réaction.
Données: C = 12 g.mol-1; H = 1 g.mol-1; O = 16 g.mol-1.
Correction
1°) a- On traduit mathématiquement les données de l'énoncé afin d'établir un système de 2 équations à 2 inconnues que l'on résout par substitution:








La formule brute recherchée est donc:

1°) b- C'est un alcane car sa formule brute est de la forme CnH2n+2; en effet, 16 est bien le double de 7 augmenté de 2.
2°) a- On demande la formule semi-développée de5 isomères de C8H18.



il y a aussi le 4-méthyl heptane mais pas le 5- qui est identique au 3-.


il y en a d'autres.
2°) b- Equation de la combustion de C8H18:
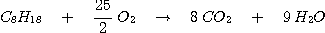
2°) c- On fait brûler 1 mole de C8H18. Le tableau suivant consigne les résultats demandés.
|
Masse molaire M |
nombre de moles n |
masse m = n x M |
|
MO2 = 2 x 16 = 32 g.mol-1 |
12,5 |
12,5 x 32 = 400 g |
|
MCO2 = 1 x 12 + 2 x 16 = 44 g.mol-1 |
8 |
8 x 44 = 352g |
|
MH2O = 2 x 1 + 1 x 16 = 18 g.mol-1 |
9 |
9 x 18 = 162g |